作者: 黃玉儀 (和信醫院核子醫學科 主任/ 台灣核醫診療標靶治療之友協會理事長) 及
李銘忻 (和信醫院核子醫學科 顧問/ 群創生物科技公司 創辦人)
🔬 放射性藥物市場的競爭格局
放射性藥物(Radiopharmaceuticals)結合了放射性同位素與靶向分子,能夠精準地將輻射劑量傳送至癌細胞,對於難以治療的癌症提供了新的治療選擇。Novartis 的 Pluvicto 是目前市場上的領先產品,已獲得 FDA 核准用於前列腺癌的治療。其他大型製藥公司如 AstraZeneca、Bristol Myers Squibb 和 Eli Lilly 也積極投入該領域,透過併購和研發擴展其放射性藥物產品線。
“While Novartis and Bayer got there first, AstraZeneca, Bristol Myers Squibb and Eli Lilly are all vying to bring their radiopharmaceutical assets to a market projected to be worth over $13 billion by 2033."
BioSpace 是一個整合「新聞資訊 + 產業趨勢 + 求才求職 + 專業見解」的綜合平台,在北美市場尤其具備高度影響力。March 31, 2025, 由Tristan Manalac 撰寫了這篇關於放射性核醫藥品市場的新聞「 5 Big Pharmas Push Boundaries in Radiopharmaceuticals」,文中提到除了Novartis 以及Bayer兩家先行者,另外三家大藥廠也陸續加入對放射性核醫藥品的投資,直至2023已經達到130億美金的規模。
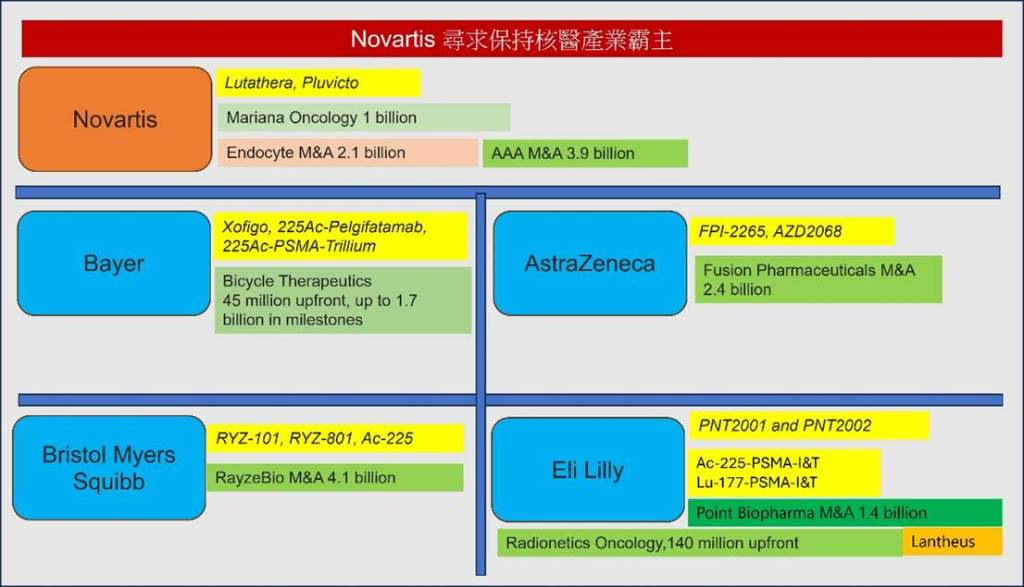
其中Eli Lilly 為了獲取Lu-177-PSMA-I&T,2023年底以14億美元併購了 Point Biopharma這家公司。而Lantheus 是 POINT Biopharma 原先合作的商業化夥伴之一,雙方簽有授權與商業化協議(如 PNT2002 與 PNT2003 等候選藥物)。併購後 Lilly 成為 POINT 的母公司,但 Lantheus 仍保有與這些產品的商業合作關係。Lantheus 主要負責試驗後期的商業化準備、市場推廣、供應鏈管理(與 POINT/Lilly 協調),Lilly(POINT Biopharma)則專注於早期開發與 GMP 製造,以及輻射性同位素供應鏈整合(擁有加拿大製造設施)。
這個月初,來自Lantheus的消息指出,在第三期臨床試驗(SPLASH 研究)中未能達到預期的整體存活期(OS)改善(LinkedIn+4Oncology Pipeline+4Synapse+4Fierce Biotech)。儘管在影像學無進展存活期(rPFS)方面顯示出一些優勢,但由於試驗中高達 85% 的交叉治療率,導致 OS 數據難以解釋。該公司決定終止PNT2002,也就是Lu-177-PSMA-I&T的試驗後期開發 (oncologypipeline, endpts)。相比之下,Novartis 的 Pluvicto 在類似的情況下仍獲得了 FDA 的批准(根據PSMAfore 臨床試驗的結果)。最終,Lantheus 決定不再推進 PNT2002 的新藥申請(NDA),並將資源轉向其他項目。
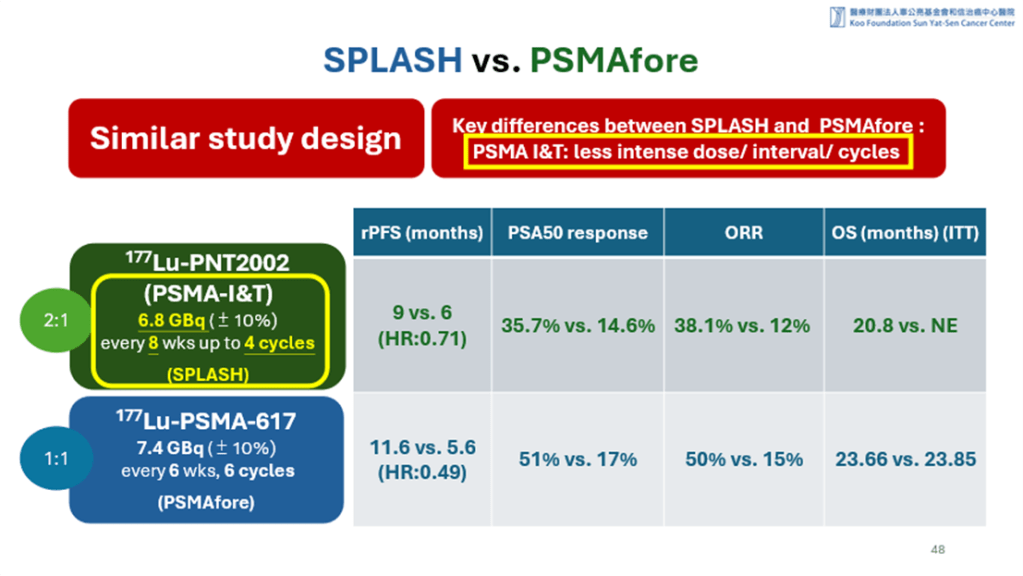
SPLASH 與PSMAfore是兩個設計相當類似的全球第三期臨床試驗,SPLASH的試驗藥物是PNT2002(Lu-177-PSMA-I&T),PSMAfore則是Pluvicto (Lu-177-PSMA-617),受試者皆為去勢療法抗性轉移性攝護腺癌(mCRPC),無化療經驗,先前接受過一種 ARPI(如 enzalutamide/abiraterone)藥物治療失敗的病人,隨機對照,與更換一種 ARPI藥物來比較療效。PSMAfore早一年在2023年搶先發表期中分析成果,確認試驗結果顯示與更換ARPI 相比,Lu-177-PSMA-617顯著改善rPFS (HR = 0.49)。SPLASH於2024年也發表了期中分析結果,同樣顯示與更換ARPI 相比,Lu-177-PSMA-I&T也顯著改善rPFS。然而雙試驗後期都遭遇交叉治療(crossover)的干擾,使 OS 資料難以支持顯著差異。不知是否因為試驗結果未超越PSMAfore,Lantheus 最終決定不遞交 PNT2002的NDA。這樣的結果也造成日後的放射靶向治療(radioligand therapy, RLT) 試驗設計避免 crossover,或設計延遲治療試驗模式(delayed crossover)以提升 OS 終點可解釋性。
SPLASH結果不如PSMAfore的原因也可能在於一些試驗設計的細節中,例如SPLASH的PNT2002藥物治療劑量低於PSMAfore的Lu-177-PSMA-617,療程間的間隔時間也較長。
🧠 觀察
- 市場競爭加劇:隨著大型製藥公司紛紛投入放射性藥物領域,市場競爭日益激烈。新進者需要在療效、安全性和供應鏈管理等方面展現出明顯優勢,才能在市場中脫穎而出。
- 臨床試驗設計的挑戰:高比例的交叉治療在臨床試驗中雖不影響主要終點的解釋,但在後期追蹤的次要終點解釋,尤其是整體存活期的評估上可能會造成極大的問題。而由於放射性治療藥物是一個全新的領域,影響療效發揮與治療副作用的評估方式與過去傳統藥物的開發截然不同,因此在試驗設計之初,納入真切了解放射性治療藥物特性相關的專家是非常重要的一環。此一領域仍是創新且在發展中,未來的試驗設計更需更整合多領域的專家,特別是核醫科的團隊,以確保試驗執行的順暢度,以及具有更高的把握來預測試驗數據的可解釋性和可靠性。
🔮 結論
放射性藥物代表了癌症治療的一個重要方向,結合了精準醫療和放射治療的優勢。然而,成功進入市場並非易事,需要在臨床試驗設計、供應鏈管理和市場策略等多方面取得突破。未來,隨著技術的進步和更多臨床數據的積累,放射性藥物依舊有望在癌症治療中發揮更大的作用。